
272
Ces Urol 2015; 19(4): 270–280
PŘEHLEDOVÝ ČLÁNEK
divám, což si vynucuje soustavné a pravidelné sle‑
dování nemocných. Samostatnou skupinou mezi
neinvadujícími nádory zaujímá karcinom
in situ
(CIS – carcinoma
in situ
), jež s sebou nese vysoké
riziko další progrese. U svalově invadujících nádorů
(MIBC – muscle-invasive bladder cancer, stadia
pT2–pT4) klesá přežití pacientů úměrně pokročilosti
onemocnění, v případě metastatického rozsevu
nepřesahuje pětileté přežití 5% (5, 6, 7).
MOLEKULÁRNÍ BIOLOGIE
UROTELIÁLNÍHO KARCINOMU
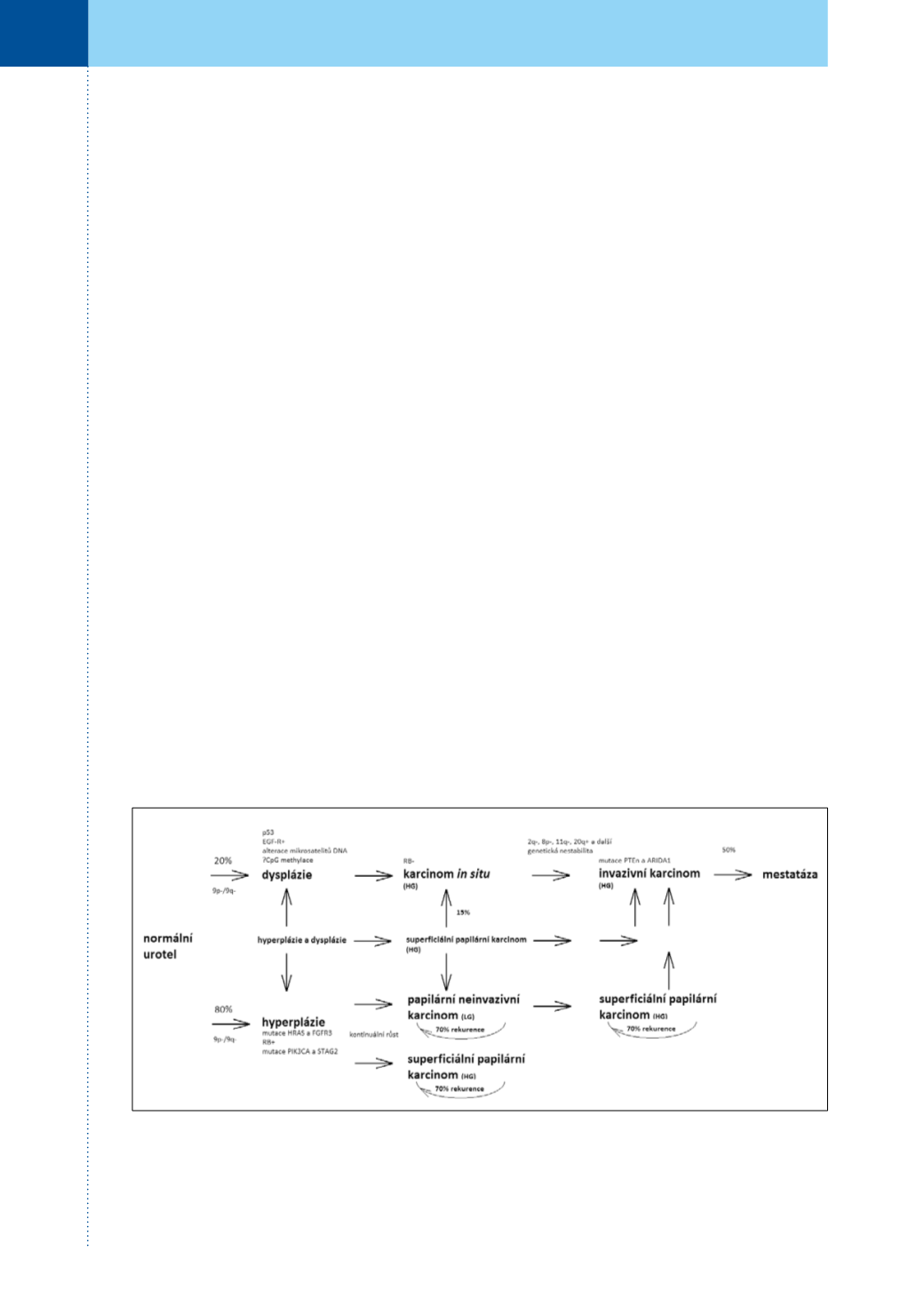
Již více než před deseti lety byla formulována hy‑
potéza, podle které probíhá vývoj povrchových
(NMIBC) a svalově invadujících (MIBC) karcinomů
z větší části nezávisle a podle odlišných molekulár‑
ních scénářů (tzv. dual track hypothesis) (7, 8). To už
je patrné na histopatologicky odlišných prekance‑
rózních stavech; zatímco povrchovým karcinomům
zpravidla předchází hyperplazie urotelu, svalově inva‑
zivní nádory se vyvíjejí většinou z plochých dysplas‑
tických lézí posléze přecházejících v karcinom
in situ
.
Tyto nezávislé dráhy tumorigeneze se ovšemmohou
křížit – zhruba 15 % původně povrchových nádorů
nakonec progreduje do invazivního fenotypu.
Molekulární biologie obou drah karcinogeneze
(obrázek 1) je také značně odlišná (9, 10, 11). Klíčo‑
vé onkogeny aktivované u povrchových nádo‑
rů způsobují především dysregulaci buněčného
cyklu a hyperproliferaci. Mutace jsou nejčastěji
nacházeny buď v systému receptorů fibroblasto‑
vých růstových faktorů (především FGFR3) ane‑
bo v onkogenech rodiny
ras
, čistým výstupem
je v obou případech konstitutivní aktivace jedné
z nejdůležitějších signálních drah, tzv. mitogen‑
-aktivované protein kinázové (MAPK) kaskády. Ty
jsou doprovázeny ztrátami (buď na úrovni genu
nebo jeho exprese) klíčových inhibitorů buněčné‑
ho cyklu p16
INK4a
a p15
INK4b
v oblasti chromozómu
9p21, tato změna je ovšem nacházena i u převážné
většiny svalově invadujících nádorů a představuje
ve většině případů tudíž zřejmě první mutaci celé
tumorigenní dráhy.
Zásadní molekulární změnu představuje u sva‑
lově invazivních nádorů destabilizace genomu;
svalově invadující nádory zaujímají třetí příčku
mezi nádory z hlediska průměrného celkového
počtu mutací, překonávají je pouze karcinomy plic
a melanom (12). Podkladem bývá často mutační
vyřazení klasického tumorového supresoru p53,
anebo rovněž nadměrná exprese genu APOBEC-3.
Proteiny rodiny APOBEC kódují enzymy s cytidin
Obr. 1.
Současnýmodel vývoje a progrese různých typů uroteliálního karcinomu a klíčových genůmutovaných
v jednotlivých stadiích (9, 10, 11)
Fig. 1.
Current model of development and progression of principal types of urothelial carcinoma, together with
crucial mutated genes (9, 10, 11)


















