118
Ces Urol 2016; 20(2): 113–122
PŘEHLEDOVÝ ČLÁNEK
mají zachován větší objem funkčního parenchy-
mu než pacienti s nefrektomií a druhostrannou
parciální resekcí a jsou i méně zatíženi vznikem
renální hypertenze.
Primární nefrektomii volíme v případě diagnos-
tických nejasností, mezi které patří neobvyklý věk
při diagnóze (pod ½ roku a nad 5 let), ruptura tu-
moru, krvácení do tumoru, masivní hematurie.
Většina dětí je operována plánovaně, jen výjimečně
musí být operace indikována urgentně, a to zej
ména v případě krvácení do tumoru a anemizaci.
Operace plánovaně během operačního programu
snižuje riziko peroperačních komplikací (18).
Poškození pouzdra nádoru, ruptura nádoru
nebo nádorový rozsev krevní či lymfatickou cestou
může významně zhoršit prognózu pacienta (19).
Počet pooperačních ruptur udává NWTS kolem
20%, SIOP 6% (1). Podle studie NWTS je větší riziko
ruptury u nádorů lokalizovaných na pravé straně
a u nádorů větších než 12 cm (19).
Ačkoliv parciální resekce (nephron sparing sur-
gery – NSS) i laparoskopický přístup nejsou stáva-
jícím protokolem doporučovány, některá centra
se těmito přístupy zabývají. V rámci SIOP a NWTS
probíhají studie, které mají za cíl shromáždit data
a zhodnotit výsledky léčby. Podle jejich výsledků
nezhoršuje NSS i laparoskopický přístup přežití
pacientů (20, 21).
Laparoskopie je oproti klasickému přístupu
znevýhodněna absencí palpačního zhodnocení
tkáně, navíc vzhledem k malému počtu pacientů,
kteří podstoupili miniinvazivní nefrektomii, chybí
zkušenosti a data. Indikace pacientů k laparosko-
pické operaci je omezena hlavně velikostí nádorů.
Z multicentrické studie pro SIOP vyplývá, že me-
dián velikosti nádorů operovaných laparoskopicky
byl 5 cm (2,8–12) a medián hmotnosti byl 134 g
(47–730). Jedná se tedy převážně o velmi malé
nádory (20).
c) Pooperační léčba
Léčba 1.–3. klinického stadia
Délka a intenzita pooperační léčby se řídí stagin-
gem: peroperačním nálezem a výsledkem histo-
logie.
◼◼
Nefroblastomy nízkého rizika
– komplet-
ně nekrotický tumor – nevyžadují v 1. KS další
léčbu, ve II. a III. stadiu jsou léčeny kombinací
vinkristin, aktinomycin (AV) po dobu 27 týdnů.
◼◼
Nádory středního rizika
jsou léčeny v I. stadiu
AV 4 týdny, ve II. stadiu kombinací AV 27 týdnů,
ve III. stadiu AV + radioterapie 27 týdnů.
◼◼
Nádory vysokého rizika
jsou v 1. klinickém
stadiu nádoru léčeny kombinací vinkristin/
aktinomycin/doxorubicin po dobu 26 týdnů.
U pacientů II. a III. stadia BT-WT následuje léčba
v kombinaci cyklofosfamid, etoposid, carbopla-
tina, doxorubicin (300 mg/m
2
). Lokální radio-
terapie je indikovaná u II. i III. stadia. Radiotera-
pie celé břišní dutiny je indikovaná v případě
ruptury nádoru (děti <1 rok 10 Gy, děti >1 rok
20 Gy), jinak se volí radioterapie lůžka tumoru
a případných metastáz v lymfatických uzlinách.
Rozdíl oproti minulému protokolu je v léčbě ná-
dorů středního rizika, kdy v I. stadiu se zkrátila léčba
a ve II. a III. stadiu se upustilo od podání etoposidu.
Zároveň se blastémový typ nefroblastomu zařadil
z nádorů středního rizika mezi nádory vysokého rizika
a je léčen agresivněji.
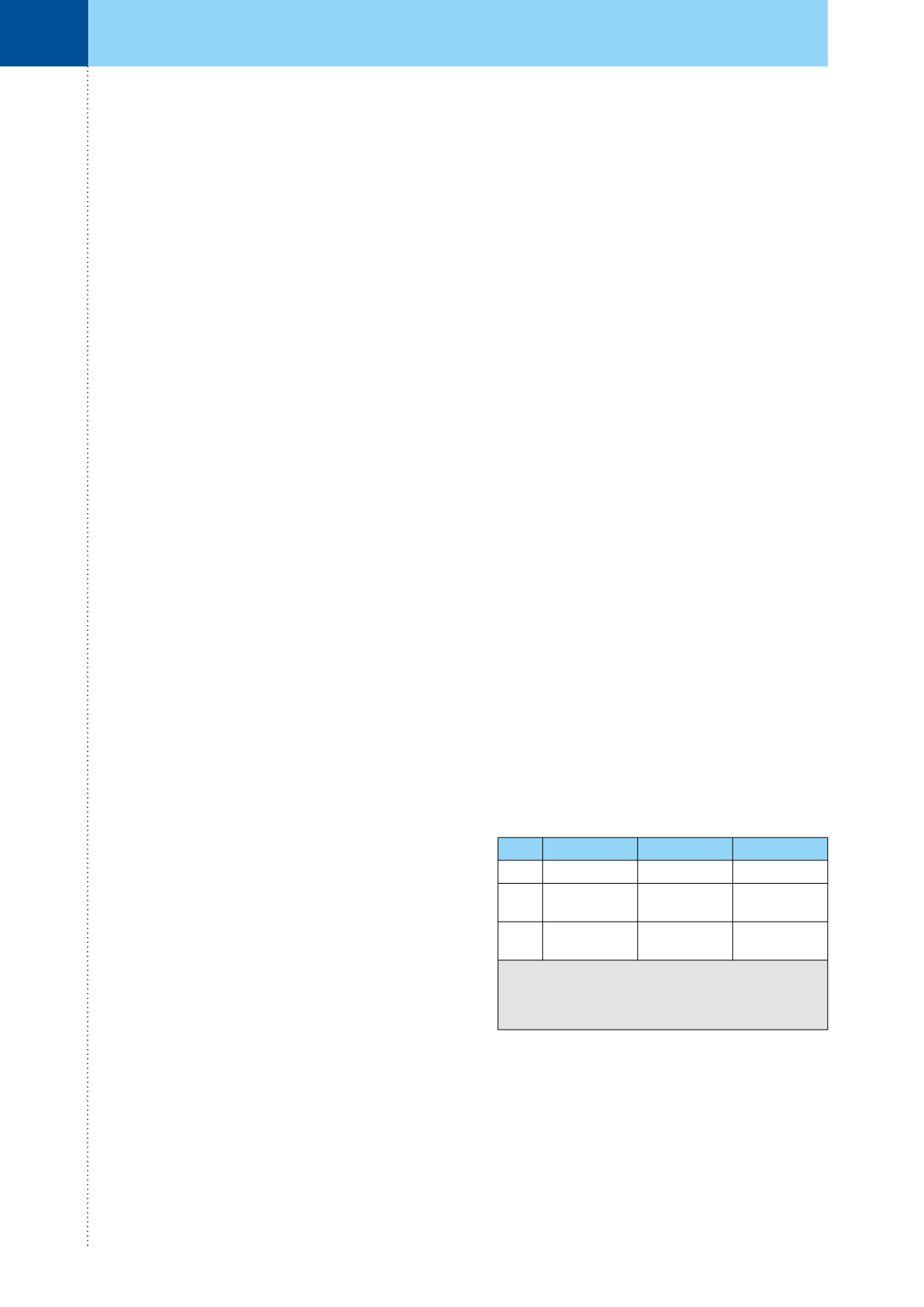
Tab. 2.
Přehled léčby lokalizovaných nádorů podle
jednotlivých typů a klinického stadia
Tab. 2.
Treatment advice for localized WT in SIOP
2001
LR
IR
HR
I. st
Bez léčby
AV 4 týdny AVD 26 týdnů
II. st
AV
27 týdnů
AV
27 týdnů
CCED+RT
34 týdnů
III. st
AV
27 týdnů
AV + RT
27 týdnů
CCED + RT
34 týdnů
LR – low risk, IR – intermediate risk, HR – high risk,
AV – aktinomycin, vinkristin, AVD – aktinomycin,
vinkristin, doxorubicin, CCED – cyclofosfamid,
carboplatina, etoposid, doxorubicin, RT – radioterapie
Léčba 4. klinického stadia
Po operaci u středního rizika, pokud je lokálně
nádor jen v ledvině a jsou přítomny reziduální
metastázy, léčíme kombinací AVD po dobu 27
týdnů bez radioterapie, pokud je lokálně nádor ve
3. stadiu pak i s lokální radioterapií. V případě neo-
perovaných nebo po CHT nemizejících metastáz je